
2022/04/04
生物樣本庫(Biobank)是采集、處理、儲存生物樣本及樣本捐獻者的臨床數據和隨訪等相關信息的機構,生物樣本包括離體的器官、組織、細胞、體液等。生物樣本庫為各類疾病基礎和臨床研究提供高質量的生物樣本,同時在精準醫學研究中扮演著重要的角色。
由于我國生物樣本庫發展時間較短,樣本庫標準化管理等方面尚在起步階段,運營管理情況不容樂觀,樣本質量參差不齊,實際利用率較低,未來應進一步加強國內生物樣本庫的標準化管理能力。因此,建立相關運營和管理規范可有效加強生物樣本庫的管理和運行監管,促進其科學有序發展,使生物樣本的有限投入發揮更大作用。

當前,CNAS已經建立生物樣本庫認可制度,采用國際標準ISO 20387《Biotechnology Biobanking General requirements for biobanking(生物樣本庫通用要求)》,是2018年8月由國際標準化組織正式發布的生物樣本庫認可體系。2019年8月30日,國家市場監督管理總局(國家標準化管理委員會)發布2019年第10號中國國家標準公告,批準GB/T 37864-2019《生物樣本庫質量和能力通用要求》(等同采用ISO 20387:2018)國家標準發布實施。
ISO 20389規定了生物樣本庫能力、公正性、持續運行(含質量控制)的通用要求,為生物樣本庫的建設提供了參考標準和技術規范。

一、我國生物樣本庫認可制度大記事



(2021年3月20日,CNAS向中科院動物研究所國家干細胞資源庫頒發了我國第一張生物樣本庫認可證書)
二、ISO 20387的主要內容
一、通用要求
《ISO 20387生物樣本庫質量和能力認可準則》要求生物樣本庫應有程序指導任何類型的生物樣本和相關數據的保藏。
與生物樣本庫活動、過程和程序相關的信息應以易理解的格式形成文件。
生物樣本庫應確定在生物樣本全部分發、處理或銷毀后,保留與這些生物樣本相關的信息記錄和數據的時間。
通俗而言,生物樣本庫應有指導生物樣本和相關數據保藏和應用的文件,即滿足標準要求的操作規范文件,確保生物樣本和相關數據能滿足可重復性研究,實現對生物樣本庫的全方位、全過程的規范化管理。
二、結構要求
生物樣本庫應是法人實體,或是法人實體的獨立部分,能對其任何行為負法律責任。政府性質的生物樣本庫被認為是法人實體,或者是與其政府地位相當的法人實體。
生物樣本庫應指定對其負有全面責任的最高管理者,應有相應的管理機構/顧問委員會以指導和建議科學、技術和/或管理行政等其他事項。
生物樣本庫開展的活動應滿足本準則、生物樣本庫協議和/或具有法律約束力的文件的要求以及提供認可的權威部門和組織的要求。
具體而言,生物樣本庫除了要設立自身的管理者/管理機構,還應設有科學委員會和倫理委員會。管理者/管理機構主要負責生物樣本庫建設的計劃、目標與預算的擬定,生物樣本庫建設的組織協調。科學委員會一般由生物醫學領域的專家組成,主要負責生物樣本采集與使用的科學審查。倫理委員會應從生物醫學領域和管理學、法學、社會學等領域的專家中推舉產生,對生物樣本收集、使用及處置進行倫理審查、監督和檢查。
需要強調一點,《中華人民共和國人類遺傳資源管理條例》已于2019年7月1日起施行,其對采集、保藏、利用、對外提供我國人類遺傳資源的活動有相關規定,如應具有法人資格、通過倫理審查、具有負責人類遺傳資源管理的部門和保藏管理制度等。當生物樣本庫業務涉及我國人類遺傳資源時,應遵守該條例,并獲得國務院科學技術行政部門批準。

三、資源要求
生物樣本庫應有專職人員、基礎設施和專用場地、設備、信息系統(信息系統可以是電子記錄或者紙質記錄)和生物樣本活動所需的支持性服務。
當生物樣本庫需要對資源、文件或檔案作出時間、日期的記錄時,應參考GB/T 7408-2005的規定。
1、人員
ISO 20387對人員的要求可分為3部分,包括總則、人員能力和能力評估以及人員培訓。
總則包括了生物樣本庫人員應當遵守公正性、保密性的原則,樣本庫應規定員工的能力要求、崗位職責和權限,并告知相關人員,維護員工的健康和安全等要求。人員能力和能力評估主要包括對人員能力的記錄和相關人力檔案的保管,確保人員的技能足以勝任其工作,以及制定能力評估的準則并讓人員定期接受能力評估。人員培訓除了針對新員工的入職培訓,還需開展適當的內/外部培訓,定期更新培訓內容。此外,所有培訓應進行督導且有文件記錄。
2、基礎設施和專用場地
生物樣本庫的基礎設施和場地應具有合理的分區和布局,以確保樣本的安全存儲、支持設備的正常運行,并為樣本庫的人員提供安全有效的工作環境。
一般來說,生物樣本庫對場地的使用可根據職能來分區,包括但不限于樣本的采集或接收區域、樣本處理區域、樣本存儲區域、辦公區域、文件和檔案保存區域等,必要時還應對開展不相容活動的相鄰區域進行有效隔離,采取措施避免交叉污染。
在規劃和日常運營中需要考慮甚至監控并記錄會影響生物樣本庫正常運作的因素,最常見的如濕度、溫度和電力供應,此外還有微生物、灰塵、電磁場分布、射線、震動等因素。生物樣本庫還應考慮庫容量擴展的問題,并制定應急預案以確保在風險情況下其基礎設施/專用場地內的環境條件符合要求。
3、外部提供的過程、產品和服務
在生物樣本庫的日常運營中,肯定會需要使用到外部所提供的一些資源。考慮到這些資源對樣本庫的影響,ISO 20387作出了相關規定。生物樣本庫除了要明確外部供應的過程、產品和服務是能滿足需求的,還應制定準則去評價、選擇、驗證和監管外部提供的資源,并保留過程中的成文信息。
4、設備
生物樣本庫應配備或控制訪問生物樣本保藏所需的所有設備(注:ISO 20387中的“設備”包括硬件和相關軟件)。生物樣本庫應建立、成文和實施程序,除了控制所有設備的操作、安全處置、運輸、儲存和計劃性維護乃至校準程序之外,還應驗證、測試每臺設備達到必要的性能并符合要求,同時建立使用和操作指南、設備信息(如標識、序列號、校準調試結果、證書等)。對于無法正常運作的設備,應停止使用并加貼標簽或隔離以防誤用。
還需留意一點,出于保護數據的完整性、真實性和可追溯性,ISO 20387還要求對關鍵設備及其軟件應采取防護措施,防止被改動并產生無效結果。

四、過程要求
應明確生物樣本及相關數據在生物樣本庫生命周期內所經歷的階段,并對適當過程進行確定和驗證。
工作流程應詳細描述生命周期所有階段的相關過程(如采集、登記、獲取、標識、保存,長期儲存、質控、運輸和棄用)的具體程序,每個程序的關鍵操作都應明確并形成文件。所有程序和過程都應持續更新并確保員工隨時可用。
在ISO 20387標準中,生物樣本及其相關數據是同等重要的,因此針對采集、接收、分發、運輸、追溯、質控、質量報告等過程要求,不僅僅是對樣本的要求,同時也是對相關數據的要求。
樣本的相關數據(associated data),即生物樣本的附屬信息,包括但不限于研究數據、表型數據、臨床數據、流行病學數據和生物樣本處理過程得到的數據等。以數據質控為例,ISO 20387規定了生物樣本庫應確定能夠影響生物樣本質量的關鍵數據,且至少對這些關鍵數據建立、成文并實施質控程序,并明確質控實施的類型和頻率。同時,數據質控應注重數據的準確性、完整性和一致性。
針對信息和數據管理,生物樣本庫應明確與生物樣本有關的必要的信息和數據,并應有信息系統用于生物樣本的追溯。尤其當當信息系統用于生物樣本庫活動時,應有計算機系統的軟件、硬件和數據庫的安裝、變更和使用程序。該程序應至少包括保護數據的完整性、安全控制和備份系統,防止數據的丟失或損壞。生物樣本庫還應明確系統未來能承載的容量,確保其能滿足進一步添加和/或處理與生物樣本相關的信息和數據。
除此之外,還有兩個很重要的要求,第一個是生物樣本庫應建立、成文并實施程序,用于管理與生物樣本庫既定要求和/或與接收者/用戶/提供者的協議不符合的輸出(nonconforming output ),同時應采取與不符合輸出造成的風險相稱的糾正措施,以防止其再次發生。按照ISO 20387 的要求,不符合輸出的處理程序不僅僅適用于該標準首次發布前所收集的生物樣本及相關數據,還同樣適用于該標準首次發布之前所收集的。第二個是生物樣本庫還應建立、成文并實施關于投訴(complaints)的接收、評估及處理程序。

五、質量管理要求
生物樣本庫應建立、成文、實施并維持質量管理體系,能支撐、論證該體系與本準則的一致性并保證生物樣本保藏質量。
樣本的質量是生物樣本庫的核心與關鍵,質量管理體系是保證樣本質量、完善樣本庫運行狀況、 實施和維護樣本庫長期可持續發展的重要因素。生物樣本庫質量管理體系至少應包含以下8項內容:
1、缺乏質量控制計劃及第三方檢測計劃;
2、質量管理體系文件控制;
3、記錄控制;
4、風險防范措施;
5、持續改進;
6、糾正措施;
7、內部審核(參考GB/T 19011-2016提供的指南);
8、質量管理評審。
此外還需注意的是,質量管理體系文件包括質量手冊、程序文件、 標準操作規程和記錄表單等,樣本庫應通過內部審核、管理評審,對體系文件中不切合實際或不合適之處進行及時的修改,并對體系文件的版本適時更新。同時,質量管理體系文件應覆蓋生物樣本庫的所有過程,包括倫理審查、 知情同意、 樣本采集、接收、處理、注釋、儲存、分發、運輸、檢測、銷毀等。
三、ISO 20387生物樣本庫CNAS認可流程
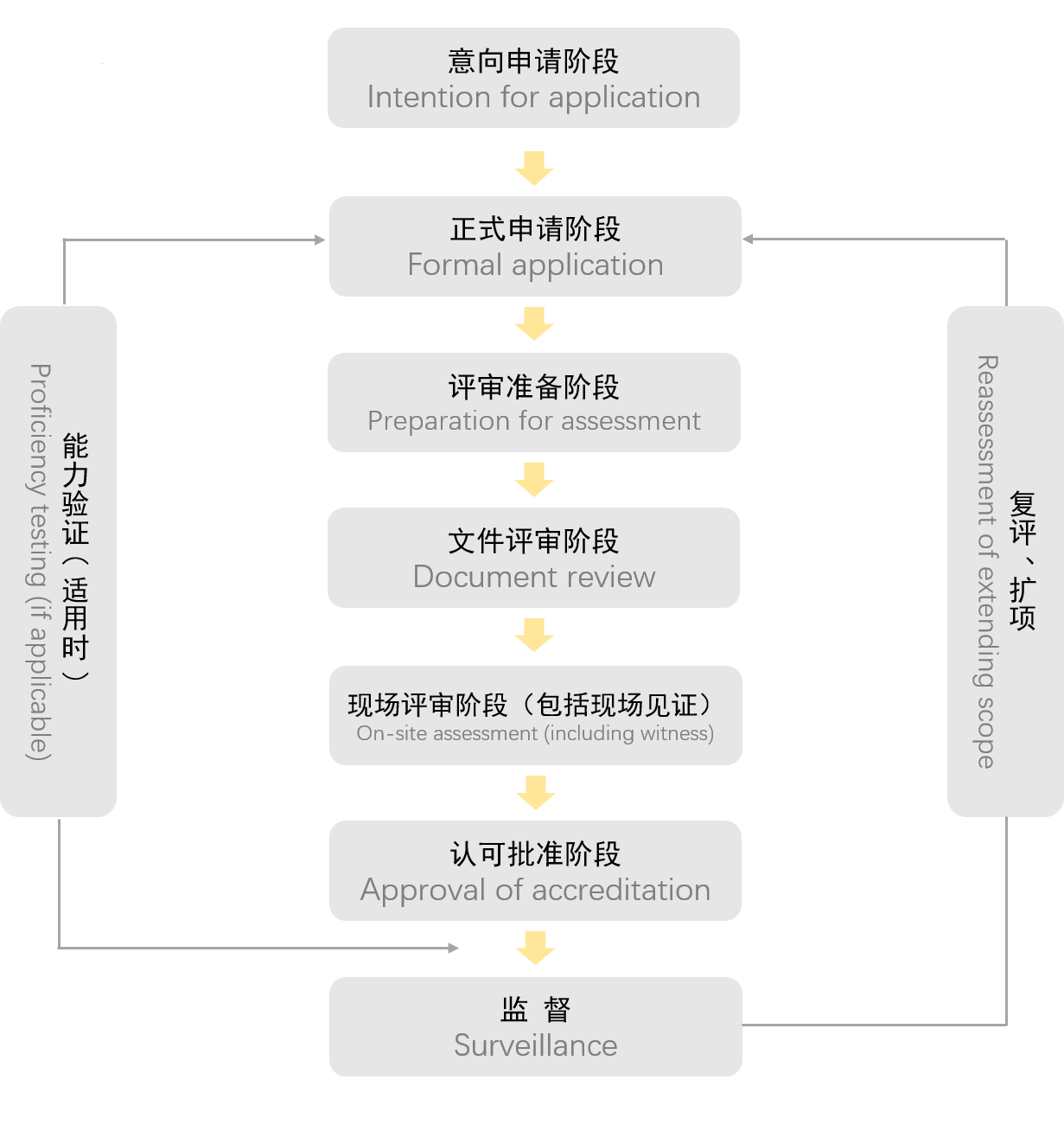
第一階段:意向申請
申請人可以用任何方式向CNAS秘書處表示認可意向,如來訪、電話、傳真以及其他電子通訊方式。CNAS秘書處應向申請人提供最新版本的認可規則和其他有關文件。
第二階段:正式申請
申請人應按CNAS?秘書處的要求提供申請資料,并交納申請費用。CNAS秘書處審查申請人正式提交的申請資料,正式受理申請。
第三階段:評審準備
CNAS秘書處以公正性和非歧視性的原則指定評審組,并征得申請人同意,如申請人基于公正性理由對評審組的任何成員表示拒絕時,秘書處經核實后應給予調整。
第四階段:文件評審
評審組審查申請人提交的質量管理體系文件和相關資料,當發現文件不符合要求時秘書處或評審組應以書面方式通知申請人采取糾正措施。在申請人采取有效糾正措施解決發現的主要問題后,評審組長方可進行現場評審。
文件審查通過后,評審組長與申請人商定現場評審的具體時間安排和評審計劃報CNAS秘書處批準后實施。
第五階段:現場評審
評審組依據CNAS的認可準則、規則和要求及有關技術標準對申請人申凊范圍內的技術能力和質量管理活動進行現場評審。
第六階段:認可批準
CNAS?秘書處負責將評審資料及所有其他相關信息(如能力驗證、投訴、 爭議等)提交給評定委員會,評定委員會對申請人與認可要求的符合性進行評價并做出決定。經評定后,由秘書處辦理相關手續。
CNAS向獲準認可機構頒發有CNAS?授權人簽章的認可證書,以及認可決定通知書和認可標識章,闡明批準的認可范圍和授權簽字人。認可證書有效期為6年。
第七階段:監督評審
監督評審的目的是為了證實獲準認可機構在認可有效期內持續地符合認可要求,并保證在認可規則和認可準則修訂后,及時將有關要求納入質量體系。所有獲準認可機構均須接受CNAS的監督評審。監督評審包括現場監督評審和其他監督活動類型。
第八階段:復評、擴項
獲準認可機構應在認可批準后的每2年進行一次CNAS復評審。獲準認可機構需要認可變更時,應在變更后一個月內以書面形式通知CNAS,CNAS在得到變更通知并核實情況后,視變更性質采取措施。
四、生物樣本庫獲得CNAS認可的十大收益
1、通過標準化的要求,確保生物樣本和數據的質量,表明生物樣本庫具備的基本的質量和能力,達到國家評定委員會的對應要求;
2、建立規范化的生物樣本庫質量管理體系,提高機構整體管理水平,提高機構整體素質和管理水平;
3、通過遵守國際標準提高機構競爭能力,提升機構形象,增強市場競爭能力,贏得政府部門,社會各界的信任;
4、通過定義、評估和控制風險,確保生物樣本庫的能力;
5、明確定義所有組織結構和管理的公正性、保密性,謹防數據的誤用和泄露;
6、提高生物樣本庫安全管理(包括生物安全和生物安保)的能力,增強機構內部安全意識,保障生物樣本庫及人員安全;
7、實現生物樣本庫資源應用和共享,促進科研成果轉化;
8、可在認可范圍內使用CNAS 國家實驗室認可標志,獲得簽署互動協議方國家和地區認可機構的承認,“一份報告發全球通行”,節省大量的時間、空間、人力、財力、物力;
9、表明具備了按照相應認可準則開展生物樣本庫的技術能力,檢測結果獲得國內外承認,并向客戶展示具有保證良好的行為規范;
10、列入獲準認可機構名錄,提高樣本庫知名度;
由此可見,ISO 20387作為生物安全的重要支撐,引入該體系不僅是加強生物樣本庫的質量管理與能力建設水平,更是推動生物安全法,加快構建國家生物安全法律法規體系、制度保障體系的重要舉措。
五、企航顧問——生物樣本庫質量及能力建設專家


企航顧問在實驗室領域的優勢:
